دخول
بحـث
المواضيع الأخيرة
المواضيع الأكثر نشاطاً
المواضيع الأكثر شعبية
تسجيل صفحاتك المفضلة في مواقع خارجية



قم بحفض و مشاطرة الرابط منتديات عالم الكهرباء على موقع حفض الصفحات
قم بحفض و مشاطرة الرابط ( عالم الكهرباء ) على موقع حفض الصفحات
هام الاخوة و الاخوات الاعضاء ماهي اقتراحاتكم للمنتدى
الثلاثاء أغسطس 13, 2013 3:14 pm من طرف ghanim
تعاليق: 1
أفضل 10 أعضاء في هذا المنتدى
| ghanim | ||||
| صقر السياسة | ||||
| sayfsaid | ||||
| المبروك حديبي | ||||
| driver | ||||
| التقني الجزائري | ||||
| اياد | ||||
| خالد | ||||
| محمد عيد | ||||
| حسن منجه |
أفضل 10 أعضاء في هذا الأسبوع
| لا يوجد مستخدم |
سبتمبر 2024
| الأحد | الإثنين | الثلاثاء | الأربعاء | الخميس | الجمعة | السبت |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 |
المتواجدون الآن ؟
ككل هناك 9 عُضو متصل حالياً :: 0 عضو مُسجل, 0 عُضو مُختفي و 9 زائر لا أحد
أكبر عدد للأعضاء المتواجدين في هذا المنتدى في نفس الوقت كان 229 بتاريخ الأربعاء ديسمبر 21, 2022 5:34 pm
الذرة
2 مشترك
( عالم الكهرباء ) :: ( ملتقى المهندسين والمدرسين واصحاب المشاريع الكهربائية ) :: ( قاعة الدروس والمحاضرات المتخصصة ) :: دروس في الفيزياء والعلوم الفيزيائية
صفحة 1 من اصل 1
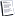 الذرة
الذرة
[ندعوك للتسجيل في المنتدى أو التعريف بنفسك لمعاينة هذه الصورة]
الذرة
هي تركيب مجهري يوجد في اية مادة عادية من حولنا. تتكون الذرات من ثلاثة أنواع من
الجزيئات الذرية الفرعية هي :
[ندعوك للتسجيل في المنتدى أو التعريف بنفسك لمعاينة هذه الصورة] الألكترونات
- ولها شحنة سالبة.
[ندعوك للتسجيل في المنتدى أو التعريف بنفسك لمعاينة هذه الصورة] البروتونات
- ولها شحنة موجبة.
[ندعوك للتسجيل في المنتدى أو التعريف بنفسك لمعاينة هذه الصورة] النيوترون -
ليس له شحنة (محايد).
الذرات
هي كتل البناء الأساسية للكيمياء، ومحفوظة في التفاعلات الكيمياوية، وهي الجزيء
الأصغر للعنصر الكيميائي ؛ عندما تنقسم ذرة عنصر معين يتوقف عن كونه ذلك العنصر، اي
يتحول الى عنصر اخر، وقد حدد عدد 91 عنصر وجدت طبيعيا على الأرض.
كل
عنصر فريد بعدد البروتونات في كل ذرة ذلك العنصر، كل ذرة لها عدد من الألكترونات
يساوي عددها من البروتونات؛ إذا حدث عدم توازن تدعى الذرة في هذه الحالة آيون او
ذرة متأينة. ذرات نفس العنصر يمكن أن تأخذ أعداد مختلفة من النيوترونات طالما عدد
البروتونات أو الألكترونات لا تتغيران، والذرات ذوات الأعداد المختلفة من النيوترون
تدعو نظائر مشعة للعنصر الكيميائي.
العناصر
الأخرى خلقت بشكل إصطناعي، لكنها عناصر غير مستقرة عادة وتلقائيا تغيير إلى العناصر
الكيميائية الطبيعية المستقرة بعمليات التحلل الإشعاعي.
مع
ذلك 91 عنصر فقط موجود بصورة طبيعية، ذرات هذه العناصر قادرة على الإلتصاق
بالجزيئات والأنواع الأخرى من المركبات الكيميائية. الجزيئات تتكون من الذرات
المتعددة؛ على سبيل المثال جزيء الماء يتكون من اتحاد ذرتين من الهيدروجين وذرة
أوكسجين واحدة.
التركيب
النموذج المقبول
على نحو واسع هو نموذج الموجه، وهو مستند على نموذج بوهر، لكن يأخذ في الحسبان
التطورات الحديثة والإكتشافات في ميكانيك الكم.
الذرات تتكون من
جزيئات فرعية (بروتونات، ألكترونات، ونيوترون)، حجم الفراغ كبير في الذرة، مركز
الذرة صغير جدا، النواة ذات شحنة موجبة وتتألف من بروتونات ونيوترون، وحجم النواة
ثمثل اصغر من 100,000 مرة من حجم الذرة.
عندما تنضم
إلكترونات إلى ذرة معينة، تستقر في القشرة الاقل طاقة، ذلك هو المدار الأقرب إلى
النواة، ويسمى (القشرة الأولى). اما الألكترونات في المدار الأبعد (قشرة التكافؤ)
فهي التي تكون جاهزة للإلتصاق الذري.
حجم الذرة
حجم
الذرة لا تحدد بسهولة حيث ان مدار الإلكترون تتحرم الصفر بشكل تدريجي حسب الزيادات
في المسافة عن النواة. للذرات التي يمكن أن تشكل بلورات صلبة، المسافة بين النوى
المجاورة يمكن أن تعطي تقدير لحجم الذرّة. للذرات التي لا تشكل بلورات الصلبة
الأخرى نستعمل تكنيك أخر، يدخل في ذلك الحسابات النظرية. كمثال، حجم ذرة الهيدروجين
تقدر تقريبا بـ 1.2 × 10-10 . قارن هذا إلى حجم البروتون الذي هو جزيء في نواة ذرة
الهيدروجين التي هي تقريبا 0.87 × 10-15 m.
هكذا النسبة بين الأحجام في ذرة الهيدروجين إلى نواتها يساوي تقريبا 100,000. ذرات
العناصر المختلفة تتفاوت في الحجم، لكن الأحجام تقريبا نفسها. إن السبب لهذا يرجع
الى تلك العناصر ذات شحنة موجبة كبيرة في النواة تجذب الألكترونات إلى مركز الذرة
بقوة أكثر.
العناصر والنظائر المشعة
الذرات تصنف
عموما بعددها الذري، الذي يقابل عدد البروتونات في الذرة. يحدد العدد الذري لاي
عنصر تنتمي تلك الذرة. على سبيل المثال، ذرات الكربون تحتوي على ستة بروتونات، كل
الذرات التي بنفس هذا العدد الذري تشارك في تشكيلة منوعة من الخواص الفزيائية
وتظهر نفس السلوك الكيميائي.
رقم
الكتلة، العدد الذري للكتلة، أو العدد النيكلوني لعنصر هو العدد الكلي للبروتونات
والنيوترون في ذرة ذلك العنصر، لأن كل بروتون أو نيوترون اساسا له كتلة من 1
amu.
عدد النيوترون في ذرة ليس له تأثير على نوع العنصر. كل عنصر يمكن أن يتخذ ذرات
مختلفة عديدة لكن بنفس عدد البروتونات والألكترونات، لكن أعداد مختلفة من
النيوترون. كل من له نفس العدد الذري لكن رقم كتلة مختلف، هذه تدعى النظائر المشعة
لعنصر ما. عند كتابة اسم نظير مشع، اسم العنصر يتبع بالرقم الكتلة. على سبيل
المثال، كربون 14 يحتوي على ستة بروتونات وثمانية نيوترونات في كل ذرّة، ليكون رقم
الكتلة الكلي من 14.
إنّ
ذرة الهيدروجين هي ابسط الذرات، لها عدد ذري 1 وتشمل بروتون واحد وإلكترون واحد.
نظائر الهيدروجين المشعة التي تحتوي نيوترون واحد تدعى الديوتوريم
Deuterium أو
هيدروجين2 ؛ إما نظائر الهيدروجين المشعة التي تحتوي على إثنان نيوترون تدعى تريتيم
Tritium أو
هيدروجين 3.
إن الكتلة الذرية
التي أدرجت لكل عنصر في الجدول الدوري هي معدل كتلة النظير المشع الموجود في
الطبيعة مرجحا بدرجة وفرتهم.
التكافؤ والتراكيب
إن السلوك
الكيميائي للذرات يعود بشكل كبير بسبب التفاعلات بين الألكترونات. ألكترونات ذرّة
معينة يجب أن تبقى ضمن الترتيبات الالكترون المتوقّعة والمحددة. تسقط الألكترونات
إلى القشور مستندة على مسافتهم النسبية من النواة (يرجع لتركيب الذرة للمزيد من
التفاصيل). الألكترونات في القشرة الأبعد، تمسى إلكترونات التكافؤ، لها التأثير
الأكبر على السلوك الكيميائي. إلكترونات المركز (تلك ليست في القشرة الخارجية) تلعب
دورا، لكنه عادة ذا تأثير ثانوي بسبب حاجز الشحنة الموجبة في نواة
الذرة.
كل غلاف، مرقم من
الأقرب إلى النواة، يمكن أن يمسك عدد محدد من الإلكترونات يعود ذلك حسب اختلاف عدد
ونوعه المدار.
الغلاف 1: 2
ألكترونات
الغلاف 2: 8
ألكترونات
الغلاف 3: 8 أو
18 ألكترون (إعتمادا على العنصر)
تملأ الألكترونات
المدارات من الداخل الى الخارج، يبدآن بغلاف واحد. تجد الاغلفة ذات الارقام الأعلى
توجد فقط عند الضرورة وتحدد بعدد الألكترونات. أي غلاف موجود خارجيا هو غلاف
التكافؤ، حتى ولو كان ذا إلكترون واحد فقط.
السبب الذي ملئ
الأغلفة بالترتيب بأن مستويات طاقة الألكترونات في الأغلفة الأعمق أقل جدا من
مستويات طاقة الألكترونات في الأغلفة الخارجية. إذن لو أن الأغلفة الداخلية لم تكن
ممتلئة تماما، الألكترون في الغلاف الخارجي يسقط بسرعة إلى الغلاف الداخلي (بإشعاع
الفوتون الذي يحمل الإختلاف في مستويات الطاقة.
الذرات في الكون والعالم من حولنا
بإستعمال نظرية التوسع، عدد الذرات في الكون المنظور يمكن توقعه بأن يكون
بين 4x1078
و6x1079 .
وبسبب الطبيعة اللانهائية للكون، فإن العدد الكلي للذرات في كامل الكون قد يكون
أكثر بكثير أو لانهائي. هذا لا يغير من العدد المتوقع للذرات في الكون الملاحظ ضمن
حوالي 14 بليون سنة ضوئية - الذي كل مايمكن أن نلاحظه فقط هو بعمر 14 بليون سنة
المصدر
[ندعوك للتسجيل في المنتدى أو التعريف بنفسك لمعاينة هذا الرابط]
 رد: الذرة
رد: الذرة
اسلوب لطيف ومبسط للشرح وخاصة لطلابالمدارس
ولكن اتمنى ان يرفق معه بعض الصور ليصبح اكثر متعة
ولكن اتمنى ان يرفق معه بعض الصور ليصبح اكثر متعة

green land- .

- عدد الرسائل : 1
الدولة : jordan
العمل : teacher
تاريخ التسجيل : 06/10/2012

( عالم الكهرباء ) :: ( ملتقى المهندسين والمدرسين واصحاب المشاريع الكهربائية ) :: ( قاعة الدروس والمحاضرات المتخصصة ) :: دروس في الفيزياء والعلوم الفيزيائية
صفحة 1 من اصل 1
صلاحيات هذا المنتدى:
لاتستطيع الرد على المواضيع في هذا المنتدى








» معلومات مهمه للكتابه على الكيبورد
» بعض اجهزة قياس الكهرباء
» انتركم سامسونج
» تصميم أنظمة الإنذار من الحريق:
» مخطط للعداد الكهربائي
» طريقة توصيل الأنترفون بشكل مختصر انترفون من نوع كومكس
» لمحة عن طريقة تمديد أسلاك الهاتف داخل البيت
» التمديدات الكهربيه بالمنازل بالصور